PCR技术改变了现代分子生物学,而Taq DNA聚合酶改变了PCR。
1986年,Mullis发明了PCR技术,当时使用的是大肠杆菌聚合酶I(Klenow),而这个酶是不耐热的,在反应体系温度升高使DNA变性的过程中会失去活性,因而每次循环都要加入新的聚合酶,操作十分麻烦,不能做到无人值守,成本也很高。
1988年,Saiki等将Taq DNA聚合酶应用于PCR技术,成功完成了DNA的自动扩增。Taq DNA聚合酶对于PCR的应用有里程碑的意义,PCR循环包括变性(90 °C左右)、退火(50°C左右)、延伸(70°C左右),每一步对温度的要求都不一样,多数酶在高温时即变性失活,然而该酶可以耐受90℃以上的高温而不失活,所以不需要每个循环加酶,使PCR技术变得非常简捷。同时也大大降低了成本,PCR技术得以大量应用,并逐步应用于临床。
一、TAQ DNA聚合酶的来源
Taq DNA聚合酶是从一种叫做水生栖热菌(Thermus aquaticus)的嗜热细菌中分离出来的(Chien, 1976),这种细菌最初是从美国黄石国家森林公园的火山温泉中分离得到的,生长在70-75℃极富矿物质的高温环境中(Brock, 1969)。Taq DNA聚合酶具有极高的热稳定性,或许能够承受PCR的热变性步骤。1988年,Saiki等将Taq DNA聚合酶用于体外PCR扩增,不但实现了PCR自动化,还因为提高了退火和延伸温度而提高了产物特异性。这个研究鼓励了更多的技术人员使用Taq DNA聚合酶进行PCR,1989年,Lawyer等利用特异性探针从Taq DNA聚合酶基因文库中钓取了Taq DNA聚合酶全长基因,最终得到一个2499bp的编码序列,GC%高达68%,他们将该基因克隆到大肠杆菌中,通过诱导表达和分离纯化得到纯的Taq DNA聚合酶。
二、TAQ DNA聚合酶的结构与功能
Taq DNA聚合酶属于聚合酶家族A,是一个单体酶,它与大肠杆菌聚合酶I(pol I)具有很高的结构相似性。1995年,Kim等公布了Taq DNA聚合酶的晶体结构,为解释其耐热性、催化活性及分子改造奠定了基础,下面将其结构特点罗列如下:
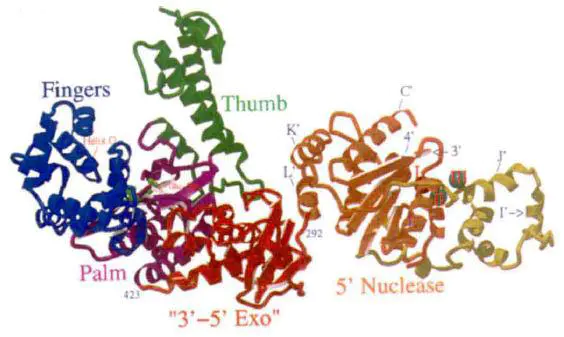
① Taq DNA聚合酶包括三个结构域,1-291:5’-3'外切核酸酶结构域,292-423:该结构域对应于pol I的3’-5'外切酶结构域,两者虽然具有结构相似性但无序列相似性,因此Taq DNA聚合酶不具有3’-5'外切活性,424-832:5’-3'聚合活性结构域。
② 5’-3'外切结构域是一个功能完整的独立结构域,该结构域的缺失不会使Taq丧失聚合活性,但对酶的催化性能有一些影响。Barnes(Barnes, 1992)构建了一个N端236aa缺失的Taq突变体,发现仍具有完整的聚合活性,且保真性有所提高。Lawyer等(Lawyer, 1993)发现N端289aa缺失的大片段耐热性比全长酶更高,且盐离子耐受能力也提高了,但持续合成活性降低十倍。Merkens等(Merkens, 1995)认为Klentaq持续合成能力的下降与5’-3'外切结构域结合DNA有关,结合作用阻止了酶与DNA底物的彻底解离,后来很多研究人员也支持这一观点。此外,5’-3'结构域还对Taq DNA聚合酶的底物特异性有很大影响,5’-3'结构域删除片段对引物3’端错配敏感性显著下降,对ddNTP的掺入能力增强。从三维结构上看外切结构域与聚合结构域距离很远(大于70Å),很难理解它是如何与聚合结构域协作的,Kim等也无法解释这个现象,他们推测5’-3'外切结构域在溶液中的位置与晶体中不同,要更接近聚合结构域。
③ Taq DNA聚合酶3’-5'外切酶结构域比pol I短,缺少4个长度8-27aa的loop结构,并且pol I中担负金属离子结合的关键残基D424、D501、D355、E357在Taq中被替换为L356、R405、G308、V310,酸性残基上的羧基能够与金属离子形成离子键,被替换后无法再与金属离子结合,Kim等推测这是Taq DNA聚合酶失去3’-5'外切酶活性的主要原因。
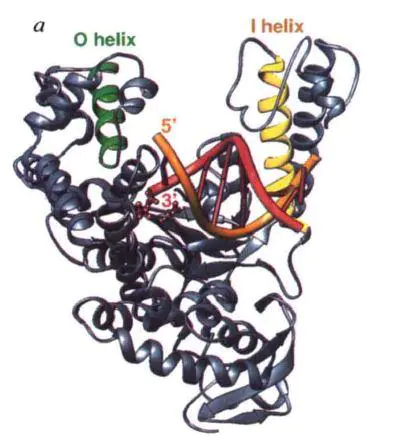
④ 5’-3'聚合活性结构域像一只右手,包括拇指(Thumb)、手掌(Palm)、手指(Fingers)结构,催化活性位点是Asp610、Asp785和Glu786位于Palm结构域中,手指结构中的O-α螺旋对底物特异性有重要作用,拇指结构中的I-α螺旋也和底物结合密切相关。
三、TAQ DNA聚合酶的特点
Taq DNA聚合酶基因全长2496个碱基,编码832个氨基酸,分子量94kD,预测的等电点约为6.0,理论总平均亲水指数为-0.282。现将其酶学特点罗列如下:
① 良好的耐热型,最适催化温度在75-80℃,95℃半小时后仍保留50%以上的活性。Taq DNA聚合酶是Mg2+依赖型聚合酶,最适浓度范围是2-4mM。Taq DNA聚合酶还需要单价阳离子,在10-55 mM KCl中具有最大活性。有研究认为Na+会抑制聚合酶活性,但有些研究中聚合酶在Na+环境中也能够正常扩增。
② 5’-3'聚合活性,该特性对温度具有较高的敏感性,70℃时,Taq DNA聚合酶能够以60nt/s的速率聚合DNA链,55℃时降为24nt/s,37℃时为1.5nt/s,22℃时基本停止扩增(Innis, 1988)。
③ 5’-3'外切核酸酶活性,Taq DNA聚合酶是少数具有这一活性的DNA聚合酶之一。1991年,Holland等(Holland, 1991)利用Taq DNA聚合酶的5’-3'外切活性切除5’端放射性标记的DNA探针,通过放射性信号的变化,实现PCR产物的特异性检测。这一研究,为qPCR技术的发展奠定了基础,从此,Taq DNA聚合酶也成了探针法qPCR技术的指定聚合酶。
④ 部分PCR产物3’末端加A,1988年,Clark等发现Taq DNA聚合酶会在新生链的3’末端添加无模板核苷酸,这一特征使Taq DNA聚合酶的PCR产物能够直接用于TA克隆。但是实际应用时,情况要复杂得多, 1993年,Hu等报道了8种聚合酶3’末端延伸的情况,发现Taq DNA聚合酶在PCR产物的3’末端添加A或其它碱基。1996年,Magnuson等系统性研究了Taq DNA聚合酶3’末端加A的概率,发现3’末端加A并不高,与反向引物5’端碱基种类密切相关,他们还指出这种不完全的碱基添加不利于在等位基因分形和TA克隆。
⑤ 无3’-5'校正活性,虽然Taq DNA聚合酶与大肠杆菌聚合酶I有很高的结构相似性(包括3’-5’外切核酸酶结构域),但它缺乏3’-5'外切核酸酶活性,这降低了其在PCR扩增中的忠实性。关于Taq DNA聚合酶的错误率,不同的报道差异很大,Tindall等(Tindall, 1988)测定的突变率为1/9000,Cline等(Cline, 1996)测定的突变率为8.0±3.9×10-6。这种差异的原因有两个:一、测试方法不同,比如lacZα和lacI,二、酶纯度和实验条件有差异。抛开这些错误率数据,实事求是的讲,我使用Taq DNA聚合酶多年,用于一般性扩增保真性还可以,一般1-2.5kb的目标片段,挑取两个克隆基本能得到正确的克隆。用于困难模板扩增时,错误率较高,挑取4-6个克隆子基本也能得到正确克隆。
(上述所列的酶的催化性能参数,在不同的研究中是有较大变化,因为可能使用的酶纯度不同,或者使用的buffer不同,模板、引物、仪器、反应体系甚至PCR管壁的薄厚都会导致PCR表现的差异。这些数据只是一个参考,实际使用中应以试验结果为准。)
四、TAQ DNA聚合酶的应用
Taq DNA聚合酶发现了几十年,不但没有被取代,反而在分子生物学领域具有越来越广泛的应用。这一方面依赖于它自身的功能和特点,另一方面也依赖于研究人员对其不断地改造。通过定点突变、结构域重组、定向进化等技术,Taq DNA聚合酶获得了许多催化性能改善或展现新功能的突变体,拓宽了酶的应用范围。下面是Taq DNA的一些应用领域。
- 热循环PCR
- 易错PCR
- 热启动PCR
- 位点特异性PCR(SNP检测)
- qPCR(Taqman法)
- TA克隆
- Sanger测序
- 二代测序
五、总结
Taq DNA聚合酶已经被改造成了各种类型以适用于不同的应用领域。在这里我们考虑它对靶向扩增子测序的影响。
- PCR错误的影响。由于Taq DNA聚合酶无3’-5'校正活性,因此在PCR延伸过程中可能发生错误,导致碱基突变。但这种错误率低于千分之一,而扩增子大小通常只有几十到几百bp。因此PCR错误的影响是很少的。
- 末端加A的影响。事实上Taq DNA聚合酶不只会向PCR产物末端加A,还会加其他碱基,这与反向引物5’端碱基种类密切相关。这在实验和生信分析过程中需要注意。
六、参考文献
从零开始学PCR系列文章:
觉得内容不错,请点个赞吧! 日拱一卒,功不唐捐,run run run。。。